Felix Rico au laboratoire Dynamique et nanoenvironnement des membranesbiologiques (DyNaMo – amU/Inserm)

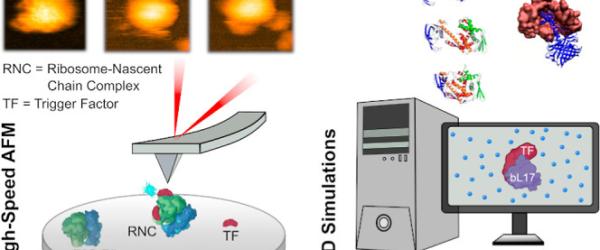
Publication dans ACS Nano Dans une cellule, une protéine commence à se replier dès sa fabrication par le ribosome ; un moment délicat où des erreurs de pliage peuvent apparaître. En combinant microscopie AFM à haute vitesse et simulations de dynamique moléculaire, l’étude a réussi à observer en temps réel le comportement d’un chaperon bactérien, appelé Trigger Factor qui protège les protéines naissantes. Les chercheurs montrent que Trigger Factor adopte très rapidement plusieurs conformations (compacte, intermédiaire, étendue) et s’ajuste de façon flexible au ribosome et à la chaîne en cours de synthèse. Fait marquant, l’étude révèle qu’il n’agit pas toujours seul : deux molécules peuvent interagir simultanément avec un même ribosome, en s’accrochant à deux zones distinctes proches de la sortie du tunnel (notamment uL23 et bL17). Ces résultats remettent en question le modèle classique connu par un chaperon pour un ribosome, et ouvrent une nouvelle compréhension plus dynamique et coopérative, de la manière dont la cellule sécurise le repliement des protéines pendant leur production.
Voir la publication sur : https://pubmed.ncbi.nlm.nih.gov/41380087